Insights : Bonjour Benoît. En quoi soigner le cerveau représente-t-il un défi pour la science ? Quelles sont les particularités de cet organe qui rendent si complexe l’administration d’une thérapie ?
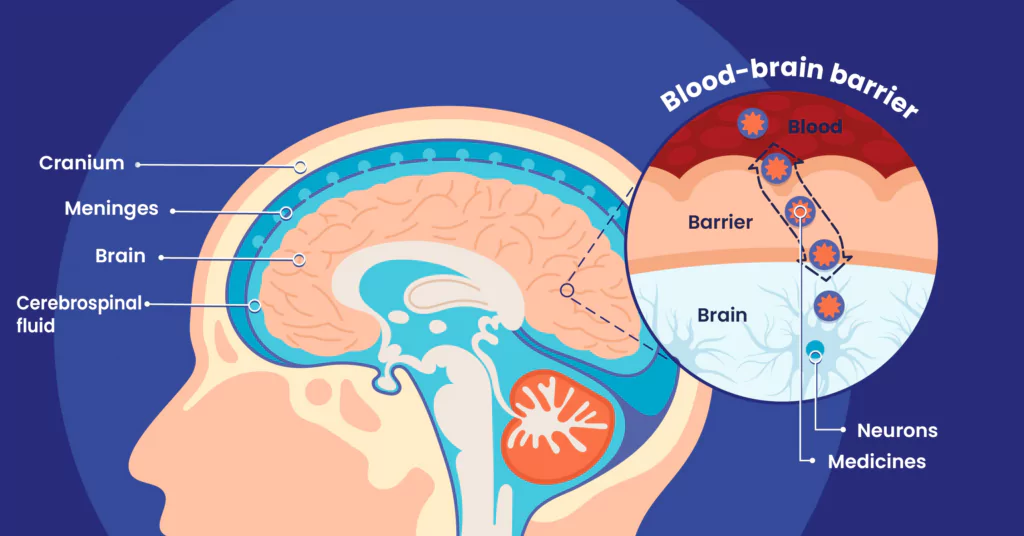
Benoît Larrat : Le cerveau a la particularité d’être un organe extrêmement bien protégé de l’extérieur, que ce soit mécaniquement par une boîte crânienne solide mais aussi physiologiquement, par des systèmes d’échanges sanguins extrêmement régulés avec le milieu extra-cérébral, au niveau des ventricules, donc du liquide céphalo-rachidien (LCR), ou au niveau du sang.
L’interface la plus sélective est la barrière hémato-encéphalique (BHE). Elle a pour rôle de réguler les échanges entre le sang et le cerveau, et en particulier d’éviter l’entrée de pathogènes potentiellement présents dans la circulation sanguine. Les vaisseaux sanguins que l’on trouve dans le cerveau ont la particularité d’être très hermétiques. Les cellules endothéliales qui les composent sont liées entre elles par des jonctions dites « serrées », des jonctions protéiques qui empêchent le passage de la plupart des substances, qu’elles soient néfastes ou thérapeutiques.
Cette barrière est quasiment infranchissable pour toutes les molécules extra-cérébrales. On estime en effet que plus de 95 %1 des molécules pharmaceutiques connues ne passent pas dans le cerveau !
Bien entendu, pour le cerveau, l’enjeu d’un tel « système de protection » est vital au départ : il s’agit de le protéger de tout élément pathogène. Il contribue également à assurer la stabilité des conditions biochimiques dans le cerveau : c’est ce qu’on appelle l’homéostasie.
Néanmoins, lorsqu’il s’agit de soigner un patient atteint d’une maladie cérébrale, comme une tumeur ou une maladie neurodégénérative, la capacité à administrer la molécule thérapeutique pour atteindre les cibles logées en milieu intracérébral constitue un véritable défi. Car en effet, bien que je sois convaincu qu’aujourd’hui des molécules existent pour soigner la plupart de ces pathologies, nous ne parvenons pas à les faire accéder en quantité suffisante aux zones où elles doivent agir.
Benoit Larrat

Benoît Larrat est diplômé de l’ESPCI Paris en physique et docteur en instrumentation médicale. Il effectue son post-doctorat au sein de NeuroSpin autour des ultrasons comme voie d’administration de substances vers le cerveau. Titularisé comme ingénieur-chercheur CEA en 2012, il y développe cette technologie chez l’animal en collaborant avec plusieurs autres laboratoires académiques et industriels. En 2020, le projet TheraSonic intègre le programme de maturation technologique et d’essaimage du CEA. Avec son co-fondateur Anthony Novell, chargé de recherche au CNRS, il conçoit et développe un prototype de dispositif médical exploitant les travaux précédents. Fin 2023, la spin-off du CEA TheraSonic, dont il prend la tête, est officiellement lancée et réalise sa première levée de fonds. L’objectif de la start-up est de valider cette technologie le plus rapidement possible sur des premiers patients en neuro-oncologie, puis d’établir des partenariats pharmaceutiques afin de démontrer la plus-value de l’approche combinant biothérapies innovantes et ultrasons.
Le cerveau est protégé physiquement et physiologiquement par plusieurs barrières protectrices, lesquelles jouent chacune un rôle bien spécifique. On peut notamment citer :
- Les os du crâne
- Les méninges
- Les mécanismes régulant les échanges entre les ventricules cérébraux remplis de liquide cérébro-spinal (LCR) et le cerveau
- La barrière hémato-encéphalique (BHE)
Insights : Et donc où en est la recherche dans ce domaine ? Quelles solutions existent pour atteindre le cerveau, et in fine, délivrer une substance thérapeutique en son sein ?
B.L : Je dirais qu’actuellement, l’idéal serait de pouvoir délivrer la bonne dose de médicament à la bonne cible thérapeutique sans recourir à une technologie de délivrance. Soigner le cerveau, c’est aussi veiller à équilibrer le bénéfice-risque pour le patient, trouver le bon compromis entre la quantité de médicament suffisante pour soigner et la toxicité induite. Compte tenu de la faible proportion qui accède au cerveau, en particulier pour les biothérapies les plus prometteuses, c’est la toxicité périphérique qui limite la dose totale acceptable à administrer au patient : on ne peut prendre aucun risque en administrant une dose trop élevée pour le patient. De nombreux efforts consistent donc à augmenter la capacité naturelle des principes actifs à traverser la BHE tout en limitant leurs effets secondaires périphériques.
Soigner le cerveau, c’est aussi veiller à équilibrer le bénéfice-risque pour le patient
Ensuite, un second point sur lequel se penchent activement les chercheurs est de résoudre le problème en proposant aux patients de nouvelles méthodes d’administration, c’est notamment notre cas.
Aujourd’hui, plusieurs méthodes existent pour atteindre le tissu cérébral. Entre autres : la délivrance intracérébrale invasive par aiguille, la « convection enhanced delivery », l’injection directe dans le liquide céphalo-rachidien, ou encore la nébulisation intranasale de principes actifs, des implants chargés en agents thérapeutiques, etc. Ces technologies montrent une certaine efficacité mais ne peuvent pas toujours s’appliquer. En outre, elles souffrent de limitations telles que l’invasivité ou le manque de ciblage. De notre côté, notre approche repose sur la technologie des ultrasons transcraniens.
Insights : Parlez-nous de votre technologie : comment fonctionnerait-t-elle ? En quoi les ultrasons pourraient-ils permettre à une molécule thérapeutique d’atteindre sa cible ?
B.L : Notre technologie est un dispositif de délivrance de médicament (ou « drug delivery system » en anglais), tout comme les systèmes précédemment évoqués. Elle a pour vocation de transporter des substances thérapeutiques vers une cible située dans le cerveau.
Notre approche consiste à émettre des ultrasons de façon pulsée, lesquels augmenteront localement la perméabilité de la barrière hémato-encéphalique à un instant T suffisamment long pour permettre l’administration de la substance thérapeutique au patient.
Très concrètement, le patient reçoit par voie intraveineuse des microbulles d’air qui sont déjà utilisées comme agents de contraste pour l’échographie. Ces bulles vont osciller sous l’effet des ultrasons. Au contact avec les parois des capillaires sanguins cérébraux, elles vont générer un stress interne aux vaisseaux, ce qui induira une ouverture temporaire des jonctions serrées et donc in fine, un bien meilleur passage des substances thérapeutiques à cet endroit. Selon le type de médicament, on peut gagner un facteur 2 à 20 en concentration cérébrale par rapport à la normale.
Quant à notre champ d’action, il est vaste. Notre technologie peut transporter vers le cerveau toutes les classes de molécules thérapeutiques : des petites molécules, des nanoparticules, des anticorps thérapeutiques et ciblés, mais aussi des vecteurs viraux pour les thérapies géniques, dans l’objectif de soigner aussi bien des maladies neurodégénératives ou rares, que des cancers, ou encore des maladies psychiatriques.
Insights : Et concrètement, qu’est-ce qu’elle apporte à ce domaine et en quoi est-elle bénéfique pour le patient ?
B.L : Le premier avantage d’une approche par ultrasons, et le critère le plus important pour nous, est qu’elle est non invasive pour le patient et lui offre un parcours de soin simplifié. En effet, après avoir longuement échangé avec des professionnels de santé, beaucoup soulevaient le fait que les patients étaient réfractaires à des traitements trop invasifs autant sur le plan physique que moral (durée de l’intervention, ou encore le fait de devoir se raser les cheveux !). C’est clef pour faire adhérer les patients à ces traitements.
Notre technologie se déroule donc en médecine ambulatoire : une heure suffit au patient pour recevoir son traitement sous ultrasons.
Ensuite, le casque que nous développons est équipé d’un dosimètre, qui adapte l’intensité du traitement à l’épaisseur de crâne de chaque patient et de chaque point de traitement. Cette approche précise contribuera à mieux calibrer le dosage de la substance thérapeutique à administrer au patient, et in fine lui délivrer le traitement le plus adapté, pour les adultes comme pour les enfants.
Enfin, pour « viser juste » et traiter automatiquement plusieurs volumes cérébraux, nous nous appuyons sur un bras robotique qui pilote le faisceau d’ultrasons avec précision afin de balayer les zones à traiter, lesquelles sont définies par les médecins sur les images médicales du patient.
Insights : Quelles sont les prochaines étapes pour le développement de cette solution ? Ou en d’autres termes, d’ici combien de temps des patients atteints d’une maladie cérébrale pourraient espérer bénéficier de cette approche médicale ?
B.L : Aujourd’hui, nous en sommes encore aux phases pré-cliniques et nous espérons pouvoir déposer un dossier pour monter une étude clinique courant 2025. A cette fin, nous venons de finaliser une première levée de fonds de près d’un million d’euros auprès du venture studio M2care et de Gustave Roussy Transfert.
Nous avons la chance d’évoluer au sein du plateau de Paris-Saclay, un écosystème particulièrement riche et stimulant pour le développement d’innovations dans le secteur de la santé. Nous sommes en effet convaincus qu’en tant que start-up, la collaboration avec d’autres partenaires est essentielle pour le développement de notre technologique. Nous sommes d’ailleurs partie-prenante du Paris-Saclay Cancer Cluster, un onco-cluster constitué d’acteurs publics et privés du périmètre géographique Paris-Saclay ayant pour mission d’accélérer l’innovation dans la lutte contre les cancers, en fournissant un cadre idéal (mentors, réseau, financements, cliniciens, données, échantillons, technologies, infrastructures et laboratoires) pour le développement de projets innovants dans le domaine de l’oncologie.

En tant qu’acteur engagé pour la lutte contre le cancer, Servier a rejoint le Paris Saclay Cancer Cluster (PSCC) en novembre 2023.
Claude Bertrand, Vice-Président Exécutif Recherche & Développement, Chief Scientific Officer, siège au sein du conseil d’administration, et plusieurs collaborateurs du Groupe ont également intégré les comités scientifiques de la gouvernance ou des groupes de travail du biocluster pour mettre à disposition leurs expertises dans le domaine de l’oncologie.
[1] (en) W. M. Pardridge, « Blood-brain barrier drug targeting : the future of brain drug development. », Mol Interv, vol. 3, 2003, p. 90–105 (PMID 14993430, lire en ligne [archive], consulté le 16 mai 2011) (Article de revue)
